耐高压臭氧发生器用于超滤膜曝气污水处理应用
一、研究背景与意义
1. 水传播病原体危害:水传播病原体与传染病相关,是公共卫生的重大威胁,全球每年约100万人因饮用水不安全、环境卫生不足和手部卫生差死于腹泻疾病。
2. 传统消毒方式局限:常用消毒剂如氯、二氧化氯和臭氧存在问题,过量使用化学消毒剂会产生有毒消毒副产物,还会导致微生物耐药性,对公共卫生造成额外风险。
3. 臭氧消毒的优缺点:臭氧因氧化电位高(2.07V)且产物无毒(O₂),被美国环保署推荐为替代传统氯消毒的消毒剂,能有效杀灭微生物,如20ppm臭氧可在4分钟内灭活空气中的烟曲霉菌,且臭氧化过程中会产生强氧化剂羟基自由基(•OH)辅助消毒。但传统臭氧化在水中的传质速率有限(约0.04min⁻¹),导致臭氧消耗量大、能耗高,限制了其广泛应用。
4. 传统曝气方式不足:依赖钛合金曝气器或冲击器的传统臭氧曝气通常产生毫米气泡,这类气泡上升速度快、气液接触面积有限,传质效率低,氧气转移效率仅6%-10%,需更高臭氧剂量才能达到预期效果,增加能耗并造成环境负面影响。
5. 微气泡曝气的潜力:微气泡曝气能提高臭氧转移速率,微气泡直径1-100μm,可将臭氧利用率提升至65%-79%。陶瓷超滤膜曝气能耗低、设备简单,是极具应用潜力的微气泡曝气方法,但目前关于陶瓷膜微气泡系统在水中的消毒性能及强化微生物消毒机制的研究有限,故开展本研究。
二、研究材料与方法
(一)材料与化学试剂
1. 培养基类:营养肉汤、MS2噬菌体液体培养基、Luria-Bertani(LB)营养琼脂、营养琼脂和MS2噬菌体半固体培养基。
2. 化学试剂:对氯苯甲酸(pCBA,>99.0%,GC)、2,4-二硝基苯肼(98%,AR,用于HPLC)、冰醋酸(99.5%,AR)和靛蓝三磺酸钾(55%,用于HPLC);麦克林生化科技有限公司提供甲酸(99%,用于HPLC)、十二水合磷酸氢二钠(99%,GR)、磷酸二氢钠(99.9%)、硫代硫酸钠(99%)和磷酸(AR);苏州安特食品有限公司提供无水乙醇;上海罗恩化学科技有限公司提供乙酸钠;上海安谱科学仪器有限公司提供叔丁醇(TBA,用于HPLC)和乙腈(HPLC级)。
3. 实验用水:采用Milli-Q水系统(美国Millipore)制备去离子水,经高压灭菌器(松下MLS-3751L)灭菌,除非另有说明,所有溶液均用灭菌去离子水配制。
(二)臭氧曝气实验系统
1. 臭氧来源:由高压臭氧发生器(北京同林代理的加拿大Absolute Ozone ATLAS P30)使用99.999%纯氧提供臭氧。
2. 流量与浓度监测:通过质量流量计(北京杰锐TSK621)控制进气臭氧流量,利用臭氧在线分析仪(北京同林科技3S-J5000)监测进出口气态臭氧浓度。
3. 反应装置:在有机玻璃制成的反应器(内径6.8cm、高度30cm、体积1.2L)内进行曝气,反应器下方设有磁力搅拌器以保证气泡均匀分布。
4. 曝气方式:将平板陶瓷膜(7.4mm×6mm×0.38mm)固定在反应器底部用于微气泡曝气,气态臭氧通过陶瓷膜 pores(直径50nm)产生微气泡;采用钛微孔曝气器进行毫米气泡曝气,通过气管连接在玻璃反应器底部。
(三)微生物选择与制备
1. 选择的微生物:从中国普通微生物菌种保藏中心(CGMCC)购买4种水中常见细菌,以大肠杆菌(E. coli;CGMCC 1.3373)和铜绿假单胞菌(P. aeruginosa,CGMCC 1.12483)作为革兰氏阴性菌代表,金黄色葡萄球菌(S. aureus,CGMCC 1.12409)和粪肠球菌(E. faecalis,CGMCC 1.2135)作为革兰氏阳性菌代表;选用MS2噬菌体(ATCC 15597)作为非包膜病毒模型,其为单链RNA病毒,与肠道病毒相似。
2. 微生物制备:详细步骤见支持信息(Text S1)。
(四)消毒实验
1. 实验设置:模型微生物初始浓度,细菌为3.8-7.2×10⁶菌落形成单位/毫升(CFU/mL),病毒为3.8-7.2×10⁶空斑形成单位/毫升(PFU/mL)。向反应器内1L灭菌磷酸盐缓冲液(PBS,5mM,pH 7.16)中加入1mL模型微生物储备液,进行臭氧曝气,臭氧进口浓度设定为10mg/L并实时监测,根据总臭氧剂量(TOD)计算臭氧投加量。
2. 样品处理:取样时用1.5倍化学计量比的硫代硫酸钠淬灭样品,收集的样品用于评估消毒效果。
3. 实际水样实验:将大肠杆菌加入自来水、河水和二级出水样品中,所有水样使用前经0.22μm聚醚砜膜过滤去除原有细菌,4℃储存,然后按上述方法进行消毒实验,水样水质参数见支持信息(Table S1)。
4. 浓度测定:采用标准涂布平板法[20]测定细菌浓度,双琼脂层法[57]测定病毒浓度,详细方法见Text S2;通过总臭氧剂量(TOD,公式1)衡量气态臭氧暴露量,公式中V为水样体积(L),t为曝气时间(min),[O₃]inletᵍ和[O₃]outletᵍ分别为进出口气态臭氧浓度(mg/L),Q为气态臭氧流量(mL/min)[16]。
(五)分析方法
1. 细胞形态分析
-细菌形态:采用扫描电子显微镜(SEM)[21]评估消毒前后细菌形态,8000rpm离心收集细菌样品,加入1.5%戊二醛在4℃下固定过夜,PBS洗涤三次后,用不同浓度乙醇溶液(10%、30%、50%、70%、80%、90%或100%)脱水,再加入叔丁醇(50%、70%或100%)置换乙醇,冷冻干燥机(日本Eyela FDU-1110)干燥后,通过SEM(日本Hitachi SU8010)观察。
-病毒形态:采用透射电子显微镜(TEM)观察病毒形态,消毒前后样品中加入2%戊二醛在4℃下固定过夜,1%磷钨酸染色后,将一滴病毒样品滴在铜网上进行透射电子显微镜观察。
2. 膜损伤流式细胞术分析
-膜完整性:使用细菌活力试剂盒(美国Thermo Fisher Scientific LIVE/DEAD BacLight L7007)表征细菌膜完整性,该试剂盒含SYTO 9和碘化丙啶(PI)两种染料,按1:6摩尔比将SYTO 9和PI混合物加入1mL细菌样品中,暗处孵育15min后进行流式细胞术(美国Beckman CytoFLEX)分析[23,22]。
-膜电位:使用双-(1,3-二丁基巴比妥酸)三甲川氧杂蒽醇(DiBAC4(3),美国Biotium)表征膜电位,向1mL细菌样品中加入5μM DiBAC4(3),37℃孵育30min后进行流式细胞术分析。
3. 细菌代谢活性检测:采用Alamar Blue试剂(中国Maokang MX3006)分析细菌代谢活性,将细菌样品与Alamar Blue染料和营养肉汤混合置于黑色96孔板中,孵育6h后,通过荧光酶标仪(美国Molecular Devices Spectra Max I3)测定样品荧光强度,按公式(2)计算细菌代谢活性,其中F₀为阴性对照组平均荧光强度,F₁为阳性对照组平均荧光强度,F为样品平均荧光强度。
4. DNA损伤分析:采用凝胶电泳进行DNA损伤分析[23,42],使用Magen HiPure细菌DNA提取试剂盒(中国Magen D3146-02)提取大肠杆菌DNA,凝胶成像仪(美国Bio-Rad Gel Doc XR)对含DNA的凝胶成像,详细步骤见Text S3。
5. 臭氧曝气分析:激光粒度分析仪(英国Malvern Mastersizer 3000)测定曝气臭氧气泡的直径分布;靛蓝三磺酸钾法[3]测定水中臭氧浓度;通过叔丁醇(TBA)与•OH的反应(Text S4)[49]确定•OH产率;采用高效液相色谱(日本Shimadzu LC-2030)按先前研究[16]描述的方法检测对氯苯甲酸(pCBA)浓度。
6. 臭氧传质模拟:采用有限元法和ANSYS Fluent软件模拟臭氧分布,针对单个微气泡和毫米气泡分析,根据气泡实际尺寸建立二维模型;曝气过程中建立反应器二维轴对称模型,利用Fluent计算流体动力学模拟微气泡和毫米气泡曝气,依据薄材料传递模拟臭氧传质,模拟过程中使用的参数(Table S2)反映实际曝气条件。
7. 能耗计算:能耗是评估成本和环境影响的重要指标,本研究中大部分能耗为臭氧产生所需电能[28,48],通过公式(3)计算单位阶跃电能(EEO),其中P₀₃为产生1g臭氧所需电能(10Wh/g-O₃),TOD为消毒所需总臭氧剂量(mg/L),V为微生物悬浮液体积(L)。
8. 统计分析:使用Origin软件进行Tukey事后检验分析显著差异,概率小于一定值时认为具有统计学意义。
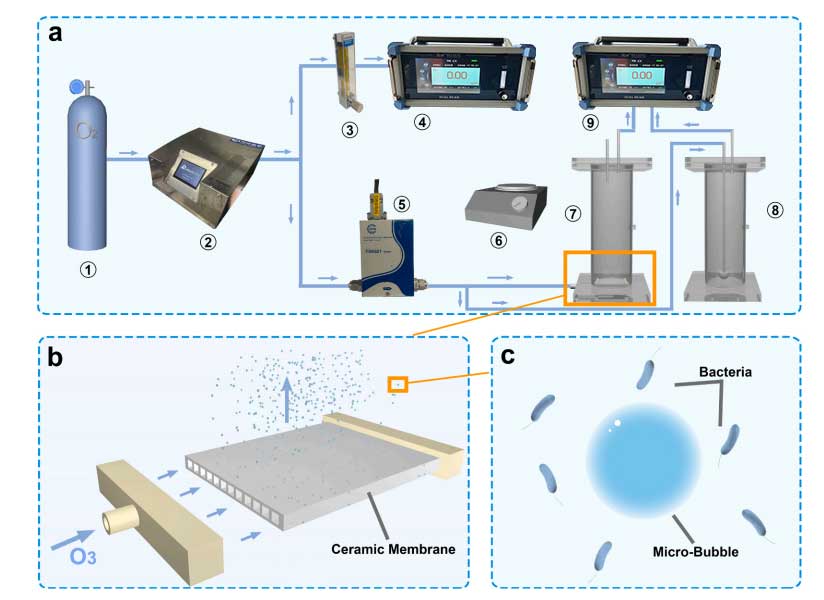
臭氧曝气系统。(a)臭氧曝气系统的气路。1)氧气瓶;2)臭氧发生器;3)流量计;4)臭氧气体浓度检测器;5)质量流量计;6)磁力搅拌器;7)微泡曝气塔;8)微泡曝气塔;9)出口臭氧气体浓度检测仪。(b)陶瓷膜曝气示意图。(c)微泡与细菌示意图。
三、研究结果与讨论
(一)臭氧曝气消毒性能
1. 不同曝气方式对比:对比臭氧微气泡曝气与毫米气泡曝气对五种代表性微生物(两种革兰氏阴性菌:大肠杆菌和铜绿假单胞菌;两种革兰氏阳性菌:金黄色葡萄球菌和粪肠球菌;一种模型病毒:MS2噬菌体)的消毒性能,总体而言,达到五种微生物4个数量级(99.99%)灭活效果,毫米气泡曝气所需臭氧剂量是微气泡曝气的三倍以上(图2a-2e和Table S3)。
2. 对不同细菌的消毒效果
-革兰氏阴性菌:微气泡曝气在极低总臭氧剂量(0.026mg/L)下对大肠杆菌实现3.2个数量级灭活,而该剂量下毫米气泡曝气无明显消毒效果;总臭氧剂量分别增至0.15mg/L和0.75mg/L时,大肠杆菌和铜绿假单胞菌实现完全灭活(>6个数量级)。
-革兰氏阳性菌:革兰氏阳性菌对臭氧抗性更强,总臭氧剂量增至0.05mg/L时,微气泡曝气对金黄色葡萄球菌的灭活率快速达到3.1个数量级,总臭氧剂量1.78mg/L时,灭活率进一步提升至6.4个数量级;而毫米气泡曝气在该总臭氧剂量下仅实现约3个数量级灭活。
3. 细菌抗性差异原因:革兰氏阴性菌更易被灭活,这与其细胞膜组成有关,革兰氏阴性菌外膜成分是脂蛋白和脂多糖[40],易被臭氧氧化;而革兰氏阳性菌细胞上有更厚的肽聚糖层,对臭氧抗性更强[62]。总体而言,相同总臭氧剂量下,微气泡曝气比毫米气泡曝气提高了臭氧消毒效率。
4. 实际水样消毒效果:评估臭氧微气泡曝气在实际水样(自来水、湖水和二级出水)中的消毒性能(图2f),所有情况下,总臭氧剂量1.0mg/L内均实现大肠杆菌4个数量级(99.99%)灭活;自来水和河水中,总臭氧剂量分别为0.38mg/L和0.72mg/L时,大肠杆菌实现完全灭活,表明臭氧微气泡曝气在不同实际水样中均具有有效的消毒效果。
(二)消毒性能增强机制
1. 微气泡物理特性与消毒贡献:陶瓷膜产生的臭氧微气泡直径范围为9.25-92.05μm(图3a),微气泡中位直径(25.5±1.3μm)仅为毫米气泡(1646.7±270.6μm)的1.5%(Figure S2)。已有研究表明微气泡与毫米气泡物理特性不同,微气泡的破裂和收缩可产生强烈的机械剪切应力和压力波,并产生自由基[24],可能有助于消毒。通过氧气微气泡曝气研究物理力对消毒的贡献(图3b-3c),与臭氧微气泡曝气相比,氧气微气泡曝气对大肠杆菌或金黄色葡萄球菌无明显消毒效果,表明本系统中微气泡物理力的贡献可忽略不计;而臭氧微气泡曝气对大肠杆菌和金黄色葡萄球菌分别实现6.3个数量级和4.5个数量级灭活,说明臭氧化的化学氧化作用在微生物消毒中起主导作用。
2. 臭氧传质与•OH生成:臭氧微气泡曝气促进臭氧传质和•OH生成,由于微气泡曝气高效的臭氧气液传质,其平衡水中臭氧浓度是毫米气泡曝气的2.38倍(图3d),这归因于臭氧表观传递速率,是毫米气泡曝气的2.80倍(Figure S3)。溶解臭氧越多,•OH暴露量越大,微气泡曝气的累积•OH是毫米气泡曝气的3.68倍(图3e),具体而言,微气泡曝气的•OH产率比毫米气泡曝气提高2.40倍(Figure S4),从而产生更多•OH。以pCBA为探针评估•OH稳态浓度(图3f),微气泡曝气下pCBA降解更快,进一步证明臭氧微气泡曝气导致更高的•OH暴露量。
3. 臭氧与•OH的消毒贡献:为探究臭氧直接消毒和•OH间接消毒的贡献,对比有无叔丁醇(TBA)时臭氧微气泡曝气的消毒性能,TBA常被用于猝灭•OH,且对细菌无明显杀灭作用[49]。添加TBA导致大肠杆菌和金黄色葡萄球菌的灭活速率常数均略有下降(图3g),表明臭氧氧化和•OH氧化均有助于消毒,且臭氧分子的直接氧化是微生物灭活的主要原因。
4. 臭氧传质有限元模拟:采用有限元模拟进一步分析微气泡曝气的臭氧传质,构建单个气泡模型以了解气泡尺寸对臭氧传质的影响,直径25.5μm的微气泡比毫米气泡具有更强的传质能力,1秒内气泡中95.82%的臭氧从气相转移到液相(不考虑气泡的收缩和破裂)(图3h);而直径1.65mm的毫米气泡中仅1.27%的臭氧从气相转移到液相。相同流量下,微气泡曝气产生更多气泡,传质热点大幅增加,因此微气泡曝气导致更高的臭氧暴露和•OH暴露。反应器内曝气模拟结果显示,5秒内微气泡曝气的平均臭氧浓度达到0.82mg/L,而毫米气泡曝气仅为0.041mg/L(图3i),臭氧微气泡曝气在整个反应器内产生更高的臭氧暴露(Figure S5),对微生物造成更大损害,提高消毒性能。
5. 能耗对比:计算两种臭氧曝气系统的EEO值,对于所有微生物,臭氧微气泡曝气的EEO值均低于毫米气泡曝气(图3j),表明臭氧微气泡曝气是一种高效且经济的微生物完全灭活方法。
(三)臭氧诱导微生物损伤表征
1. 微生物形态变化:通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察微生物形态变化以研究臭氧曝气后的细胞结构损伤(图4a)。活的大肠杆菌表面光滑、结构完整[38,47];毫米气泡曝气后,大肠杆菌表面略有收缩,但结构仍相对完整,表明损伤较小;而微气泡曝气后,大肠杆菌表面塌陷且出现孔洞。革兰氏阳性菌(金黄色葡萄球菌)经臭氧微气泡曝气后发生收缩,而臭氧毫米气泡曝气后未观察到明显的结构变化(图4b),表明细胞壁更厚的革兰氏阳性菌对臭氧损伤的抗性更强。MS2噬菌体经臭氧微气泡曝气后,衣壳明显扭曲和断裂(图4c),说明与毫米气泡曝气相比,微气泡曝气对细菌细胞和病毒衣壳结构造成更严重的破坏。
2. 大肠杆菌膜完整性与膜电位:采用流式细胞术进一步评估大肠杆菌细胞膜完整性(图4d),SYTO 9可穿透所有细菌的膜并与细胞核结合标记所有细菌,PI仅能穿透受损细菌,可用于标记细胞膜受损的细菌并评估膜损伤程度[52]。根据PI和SYTO 9信号强度,流式荧光点图分为四个象限(Q1-Q4),Q1为SYTO 9信号高、PI信号弱的完整细胞,Q2为SYTO 9和PI信号均高的轻度受损细胞,Q3为PI信号高、SYTO 9信号低的严重受损细胞,Q4为未明显染色的细胞碎片[31]。处理前,91.94%的细菌处于Q1;微气泡曝气后,98.51%的细菌处于Q3,表明该处理造成严重的细胞损伤;毫米气泡曝气后,43.56%的细菌处于Q2,51.34%的细菌处于Q3,表明毫米气泡曝气造成的损伤较小,这与SEM表征结果一致。细胞膜电位变化也与此相符(图4e)。
3. 大肠杆菌代谢活性:采用Alamar Blue(一种无毒且可穿透细胞的染料)评估大肠杆菌的代谢活性(图4f),该蓝色染料可被细胞摄取并在细胞内还原为粉红色的试卤灵,通过测量荧光可确定细菌的代谢活性。毫米气泡曝气后细菌的代谢活性高达处理前的90%;而微气泡处理后,细菌的代谢活性仅为处理前的3.19%。结果表明,微气泡曝气提高了臭氧浓度,造成严重的细胞膜损伤,使臭氧能够进入细胞并氧化细胞内成分,从而破坏细胞代谢活性,臭氧微气泡曝气极大地损害了细胞活力并诱导细胞死亡[59]。
4. 大肠杆菌DNA损伤:通过凝胶电泳评估DNA完整性,证实臭氧微气泡曝气对细胞内成分的损伤[25]。活细菌的DNA条带亮度集中在42.5kb处(图4g);微气泡曝气0.5min后,核酸条带分散,曝气1.5min后无明显条带,表明持续的臭氧氧化使DNA完全破坏或断裂成小片段。细胞膜受损时,臭氧可能进入细菌并氧化细胞内物质和DNA。对于毫米气泡曝气,处理1min时仍可观察到核酸条带,之后随着曝气时间增加才逐渐分散,表明即使在低总臭氧剂量下,微气泡曝气对DNA的损伤也比毫米气泡曝气更大。
(四)微气泡曝气增强臭氧消毒机制
根据实验结果得出的消毒机制如图5所示,微气泡曝气显著提高了臭氧的传质速率,使水中的平衡臭氧浓度更高(图3d)。此外,在相同流速下,与毫米气泡曝气相比,微气泡曝气产生更多的气泡,增加了臭氧与微生物的接触面积[61]。因此,微生物暴露在更高浓度的臭氧中,导致更严重的膜损伤(图5a),这种损伤是由于臭氧与细菌接触后迅速降解细胞膜表面成分[10],导致细胞内容物泄漏和细菌收缩(图4a-4b)。此外,臭氧通过受损的细胞膜迅速进入细胞,氧化并破坏DNA等细胞内成分(图4g),导致细胞活力大幅下降(图5b)。总体而言,微气泡曝气是一种增强臭氧对微生物消毒效果的有效方法,与毫米气泡曝气相比,微气泡曝气实现微生物完全灭活所需的臭氧剂量更低。
四、研究结论
1. 消毒效果显著:低总臭氧剂量(约1.0mg/L)即可有效实现完全消毒,降低了大肠杆菌和MS2噬菌体6个数量级灭活所需的总臭氧剂量,同时将金黄色葡萄球菌和粪肠球菌的消毒效果提升了3个数量级。
2. 传质与•OH生成优势:优异的消毒性能源于臭氧传质能力的增强和•OH生成的增加,与毫米气泡曝气相比,微气泡曝气有效提高了平衡水中臭氧浓度(1.38倍)和•OH产率(2.40倍)。
3. 微生物损伤严重:细菌膜的成分和结构受到严重破坏,细胞内细菌DNA被氧化和断裂,导致细胞活力大幅下降(>80%),降低了基因释放到水中的风险。
4. 实际应用潜力与挑战:本研究中使用的耐腐蚀陶瓷膜延长了微气泡曝气在实际应用中的使用寿命,但实际水体成分复杂(含胶体、颗粒、溶解性有机物和离子),可能导致膜污染或堵塞。可通过预处理、工艺参数优化和定期清洗等策略延长膜的使用寿命,未来需进一步研究不同水质条件下微气泡曝气的长期性能。
5. 综合效益良好:微气泡曝气对多种病原微生物(包括各种革兰氏阴性菌、革兰氏阳性菌以及病毒)表现出优异的消毒性能,且对不同微生物的能耗降低了37.2%以上。通过降低所需氧化剂剂量,臭氧微气泡曝气为更可持续、更安全的水处理做出了贡献。
五、环境意义
臭氧实际应用中存在传质速率低的问题,需高臭氧剂量和高能耗才能达到消毒目标。本研究提出的微气泡曝气方法克服了传统曝气的局限性,能以低臭氧需求量实现对多种微生物的绿色高效消毒,微生物灭活能耗降低37.2%,研究结果凸显了微气泡曝气在降低臭氧消毒总成本和环境影响方面的潜力。
六、附录说明
与本文相关的补充数据可在在线版本(doi:10.1016/j.jhazmat.2025.138174)中找到。



 当前位置:
当前位置: 
 摘要
摘要 上一篇:
上一篇: 返回列表
返回列表
